相比心血管病治疗,卒中的治疗越来越成为临床棘手问题,比心血管病需思考的细节更多。美国当地时间2月13日7:00AM~8:15AM,多位专家对近年更新的卒中治疗相关指南进行介绍,旨在为临床实践提供更多更全面的依据。
AHA/ASA卒中姑息治疗和临终医疗的科学声明
美国心脏协会/美国卒中协会(AHA/ASA)发表了有关姑息治疗卒中患者的科学声明。2014年3月27日,该声明在线发表于Stroke杂志,强调医疗团队合作对个性化护理、优化生活质量以及减少痛苦的重要性。这是美国第一次概括姑息治疗的基本概念。姑息治疗定义为以患者和家庭为中心的护理,并通过预测、预防和治疗来改善卒中患者的生活质量。

纽约罗彻斯特大学 Robert Holloway
姑息治疗定义 姑息治疗表示能改善生活质量的以患者和家庭为中心的护理,旨在预测、预防和治疗疾病。姑息治疗服务通常与延长生命的药物治疗同步,或完全独立于药物治疗。
首先,所有卒中患者均应进行初级姑息治疗评估,目的有以下几方面:①促进和践行以患者和家庭为中心的治疗;②有效评估和交流诊断结果;③熟知相关证据;④评估和有效管理急性卒中症状;⑤在临终阶段实施有证据的护理;⑥坚持协作护理,包括转运患者到临终安养院;⑦有效参与持续质量改进和研究。第二,特殊姑息治疗的复杂问题需向一线团队咨询。第三,在临终阶段顽固性疼痛或其他症状;第四,关注抑郁、焦虑、悲伤等复杂情绪;第五,患者要求加速死亡;第六,协助解决冲突问题。
预后评估 对患者和家属来说,最重要的是确定康复的方面,警惕内在不确定性,局限以及潜在的偏见。建议根据患者治疗过程,结合临床效果使用经过验证的预后模型。模型为导向的预后评估尚未建立用于卒中后临终治疗决策。医生应当向患者和家属解释预后的不确定性。
设置阶段性目标 首先应具备有效的交流工具,整合最可行的科学证据和患者倾向,周期性随访患者倾向,讨论并调整治疗目标。
症状检测和管理 卒中后身体症状包括中枢性疼痛、单侧肩痛、疲劳、性功能减退以及白天过度嗜睡。卒中后心里症状包括抑郁、焦虑、神智丧失和情绪不稳等。
社会负担 防治照料者本身失去耐心,参与、发现并管理情绪,发展自身护理措施。
临终姑息治疗 撤掉生命维持治疗和强制治疗是合适的治疗方案,但该计划仅在与代理决策者合作时可作出。患者若有难以控制的身体症状,如呼吸困难、疼痛等,在临终阶段应实施最小剂量有效镇静治疗,对缓解难以控制的症状很有必要。
临终安养院 如果卒中患者预计生存期≤6个月,且患者初级治疗目标为姑息治疗,建议运送至临终安养院。
培训和质量改进研究 对卒中患者和家属要进行持续教育,包括培训姑息治疗关键核心资质和临终关怀。对护理质量的改进也行进一步研究。
2014 AHA/ASA专家共识:卒中幸存者的体力活动和锻炼建议
2014年5月20日,美国心脏协会(AHA)和美国卒中协会(ASA)发布了一项新的科学声明,将体力活动和锻炼纳入卒中后患者管理之中。这项声明是对2004年卒中患者体力活动指南的更新。新指南得到了美国神经病学学会的认可。全文发表于《Stroke》杂志。指南写作组负责人、堪萨斯大学医学中心Sandra A. Billinger博士指出,新指南的证据更强,因为我们纳入了随机对照试验结果。

堪萨斯大学医学中心 Sandra A. Billinger
此项科学声明对卒中幸存者和照料者更具知道意义,声明回顾了体力活动和锻炼的医学证据,强调体力运动的获益,指出体力活动应贯穿于整个卒中康复过程。
进行体力活动前需进行评估,首先是患者心血管风险,高危患者需医学评估并对运动进行监督。其次检查患者神经系统/心肺功能稳定性和血液动力学应答,患者应尽早下床活动,但并未指出具体时机。
运动测试分级 优化评估患者运动功能和心血管反应,包括心率、心律、运动时心电图、收缩压/舒张压以及运动时主观反应。作为最大运动分级测试的替代,患者可进行次级最大强度测试,如运动平板试验、脚踏车试验和横卧步进亚极量运动试验,6分钟步行试验,检测运动处方后氧分压。
运动处方 其根本目的是改善有氧运动能力、改善步行效能,增强功能性独立、减少心血管事件再发、改善认知功能、延长步行耐力、预防心血管危险因素、加强血管保健。持续长期训练能增加日常活动独立性,有弹性的训练能增强运动幅度并预防残疾,神经肌肉训练课增强平衡性和协调性。运动处方应当既安全又有效,防止运动不足和运动过量,应采取适当的频率、强度,合适的时间和运动类型。
共识中几乎没有对急性期卒中康复的有氧运动推荐,只有支持前24 h早期代谢安全和可行性数据,还需进一步研究。亚急性期卒中康复方面,共识支持运动训练改善心肺适应能力,包括脚踏车测力、运动平板锻炼和机器人协助步态训练。少有研究指导亚急性期患者进行康复训练。在卒中慢性期,研究支持有氧运动改善心肺参数,如果个体可耐受,常规训练改善整体健康水平,分配给有氧运动训练和肌肉强化训练更多时间,例如社区集体活动可让患者预后更佳。
严重卒中干预 现有研究集中在轻中度残疾患者,并未对严重卒中患者进行研究。严重卒中患者的潜在治疗方法包括机电行走,主要关注步态和移动性。针对运动平板试验协助机器人外骨骼训练的相关研究显示有氧运动获益。
实践和试验障碍 大部分研究纳入不稳定卒中幸存者,提示医生对更多致残卒中采取治疗措施,对幸存者的治疗更具挑战性。实践中遇到的障碍包括患者抑郁、疲惫、动力或兴趣缺失、自我效能感缺失、对运动训练系统缺乏信心、恐惧(衰老、继发性卒中和其他并发症)以及社会支持缺失。
治疗差距 指南推荐和临床医生处方行为之间也存在差异。包括是否检测心电图,依据临床观察和主观报告处方,而不是客观测量(峰值心率和峰值氧耗)。卒中后多久开始启动递进负荷运动试验尚无文献支持。
总之,卒中后运动不充分会降低治疗价值,运动带来的获益已有证据支持。早期募集住院和社区患者进行专业运动训练确实影响生活方式,改善整体健康。
AHA/ASA关于颈动脉夹层及与颈部推拿联系的科学声明

芝加哥罗瑶拉大学 Jose Biller
流行病学
年轻患者缺血性卒中风险和原因从病原学角度讲,大血管动脉粥样硬化发生率为2%~11%,小血管病占7%~14%,心脏栓塞相关占20%~47%,其他明确病因(如颈动脉夹层)为20%~34%,多因素为2%~3%。
颈动脉夹层 通常为自发或外伤导致,表现为一个或多个动脉层撕裂,颈动脉狭窄、闭塞、夹层动脉瘤、腔内血栓、外渗出血,病变可发生于内膜下/子外膜或两者兼有。颈动脉夹层有诸多缺陷,包括真皮层胶原纤维和弹性纤维超微结构病变,呈现季节性变化,常在秋季和冬季,可能由感染引起,或与C反应蛋白有关,提示炎症反应可能参与颈动脉夹层发生,与缺血性卒中相比,较少有典型血管性危险因素,颈动脉夹层相关因素如表1。
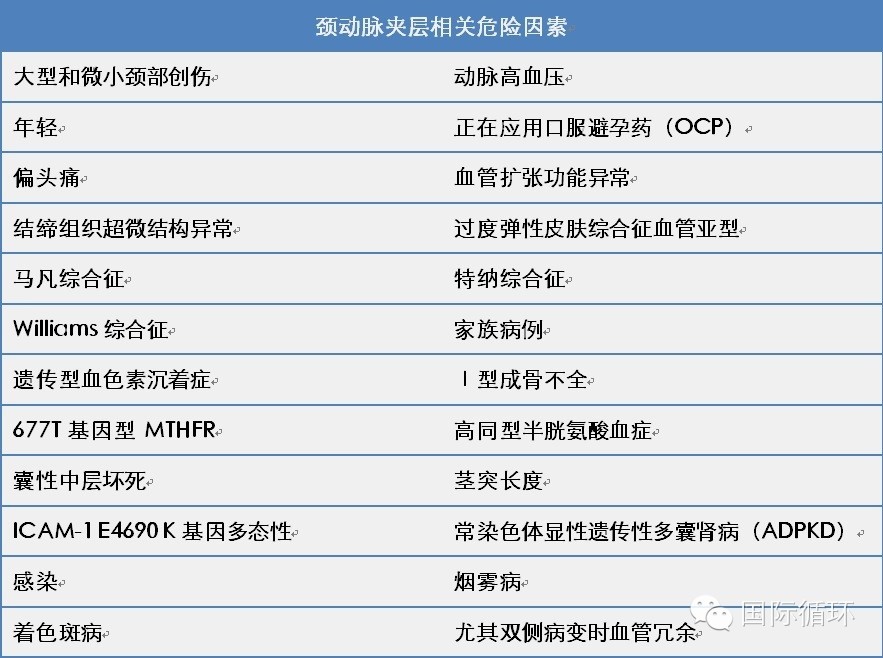
表1. 颈动脉夹层相关因素
创伤性颅外动脉夹层分为颈动脉夹层和颈椎动脉夹层。颈动脉夹层的引发因素可由直接损伤导致,如动脉损伤和下颌骨骨折,其他包括颈椎C2-3段拉伸,颅底骨折,扁桃腺损伤、窒息以及路脑损伤。颈椎动脉夹层主要诱因有寰枢关节半脱位,颈椎骨折,颈椎伸展或旋转过度,颈部推拿,枕骨大孔区肿瘤,头部撞击(重金属摇滚)。运动和颈动脉夹层也有密切关系。
颈部推拿定义为低速或高速低振幅按摩脊柱。颈动脉夹层和颈部推拿的关系来源于4项大规模研究,大部分患者为椎基底卒中,研究仅提示相关性,但并未得出因果关系结论。与颈部推拿相关的颈动脉夹层发生率从3:7.5万降至1/50~100万,椎动脉夹层发生率从5/10万降至1/200万。颈动脉夹层发生率远高于椎动脉夹层。
生理机制
颈部旋转和拉伸可导致血管拉伸,从而导致动脉血管夹层。拉伸可能导致血管腔狭窄,促进动脉内血栓形成。颈部推拿典型手法包括旋转、侧弯、屈曲、拉伸等。颈部推拿时颈椎骨质增生疾病或其他解剖学变异可能增加血管损害。颈动脉前段灌注可能涉及血管V4段,使血流变慢,单纯的V4段损害可能与血管扭转并穿透硬脑膜有关。若V4段发生夹层动脉瘤会导致蛛网膜下腔出血,但与颈部推拿无关。颈内动脉也可能在颈部推拿过程中受损。
患者预后
颈动脉夹层死亡率<5%,损伤后卒中年发生率≤1%。有家族史患者奉献更高。患者病发后前2个月内复发率较高,缺血性事件年发生率为0.3%~3.4%。缺血性事件发生风险与参与动脉狭窄或夹层动脉瘤并无显著相关性。诊断为颈动脉夹层复发定义为良性。
诊断警告
当患者年轻且有明显临床症状,无常见心血管危险因素,需疑诊为颈动脉夹层。放射检测并未发现其他典型颅内动脉病,可诊断为颈动脉夹层。没有诊断金标准。建议采取血管壁影像学检测,必要时重复多次。
血管再通时机
建议在发生颈动脉狭窄的前6个月内或更早,再通率约85%,应对闭塞的颈动脉夹层血管再通多次进行非侵入性研究,也可对治疗期间的抗血小板和抗栓治疗进行指导。
治疗策略
可用抗凝剂和抗血小板药。英国调查显示,临床用抗凝剂治疗者有50%,30%接受抗血小板治疗,20%接受上述两种治疗。在治疗期间,因颈动脉夹层导致的急性缺血性卒中不建议停止溶栓治疗,对颅外经动脉夹层不建议手术治疗。
急性期治疗通常采用静脉内溶栓,对颈动脉夹层后急性缺血性卒中患者安全。血管内治疗尚无随机试验支持,建议保守治疗,除非患者有药物治疗禁忌或硬膜内扩展增加蛛网膜下腔出血风险。
AHA指南更新:缺血性卒中和TIA患者卒中预防

耶鲁大学医学院Walter N. Kernan
指南进行以下更新:①所有患者均应筛查肥胖,检测体质指数(BMI),Ⅰ类证据,C级推荐;②所有患者应接受糖尿病筛查,Ⅱa类证据,C级推荐;③筛查血栓形成情况的用处并不明确,Ⅱb类证据,C级推荐;④可考虑睡眠期间研究,Ⅱb类证据,B级推荐;⑤未提及常规筛查同型半胱氨酸血症,Ⅲ类证据,C级推荐;⑥卒中或短暂性脑缺血发作(TIA)患者若无磷酸酯抗体综合征的临床表现,或有缺血性事件的其他机制如动脉粥样硬化,颈动脉狭窄或血栓,不推荐常规筛查抗磷酸酯抗体,Ⅲ类证据,C级推荐。
饮食和运动管理
减轻体重可带来不少获益,比如降压、降血糖、降低C反应蛋白,提升胰岛素敏感性,降低甘油三酯,提升高密度脂蛋白(HDL)水平。2013年一项发表在NEJM的研究发现,地中海饮食更能降低卒中、心肌梗死或心血管死亡,也可显著降低卒中风险。
指南建议,盐摄入应<2.4 g(Ⅱa,C);建议执行地中海饮食(Ⅱa,C);如果患者有意愿,建议参加运动项目(Ⅱa,C);针对肥胖的治疗获益并不确定(Ⅱb,C)。
血压管理
2013年多项相关指南建议,卒中后患者若血压≥140 mm Hg[ESH/ESC指南、AHA/ACC/CDC指南和JNC 8指南(<60岁)],应启动降压治疗。本指南建议,缺血性卒中/TIA患者如果前期未接受降压治疗,如果在发病几天后,血压≥140/90 mm Hg,应启动降压治疗(Ⅰ,B);对血压<140/90 mm Hg者启动降压治疗,获益不明确(Ⅰb,C);降压目标值或应从基线水平降低多少并不确定,应个体化,但应低于104/90 mm Hg(Ⅱa,B);近期腔隙性卒中患者,建议收缩压应低于130 mm Hg(Ⅱb,B)。据统计,血压达标(<140/90 mm Hg)卒中患者不足70%。
抗血小板治疗
TIA和轻型卒中患者是双联抗血小板治疗的特殊情况。指南建议,对轻型卒中和TIA患者发作24 h内联合阿司匹林和氯吡格雷治疗21天(Ⅱb,B);近30天因颅内主要动脉严重狭窄(70%~99%)导致卒中或TIA的患者,在阿司匹林基础上联合氯吡格雷75 mg/d治疗90天可能获益(Ⅱb,B)。
机械心脏瓣膜是阿司匹林联合口服抗凝剂的特殊情况。置入机械三尖瓣或主动脉瓣的患者,如在置入前有缺血性卒中或TIA病史且出血风险低,建议在维生素K拮抗剂基础上联用阿司匹林75~100 mg/d(Ⅰ,B)。
心房颤动和冠状动脉疾病是阿司匹林联合口服抗凝剂的另一特殊情况。对缺血性卒中或TIA患者不建议联合口服抗凝剂和抗血小板治疗,但如患者有明显冠心病临床症状,尤其是急性冠状动脉综合征或置入支架者,建议应用(Ⅱb,C)。有急性缺血性卒中或TIA病史的患者,如无其他明显诱因,建议6个月内延长心律监测(≈30天)筛查房颤(Ⅱa,C)。
对缺血性卒中后非瓣膜性房颤患者口服抗凝剂的指导
指南更新建议,对所有缺血性卒中或TIA患者均应处方口服抗凝剂,分享处方药决策,可选药物包括华法林、阿哌沙班和达比加群,肾功能受损者建议应用新口服抗凝剂,Ⅰ类证据;更新建议推荐利伐沙班证据为Ⅱa类;对大部分患者,在14天内应启动抗凝治疗,Ⅱa类证据。
症状性颈动脉狭窄的推荐
如非侵入性检测发现患者颈动脉狭窄>70%或放射检测狭窄>50%,颈动脉支架术(CAS)可作为颈动脉内膜剥脱术(CEA)的替代治疗,但仅在手术并发症发生率和死亡率<6%时采用,Ⅱa类证据;对老年患者或不良解剖学特征者,CEA优于CAS,Ⅱa类证据;因颅内主要动脉中度狭窄(50%~69%)导致的卒中或TIA患者,不推荐行血管成形术或支架术(Ⅲ,B);因严重狭窄(70%~99%)导致的卒中或TIA患者,不推荐Wingspan支架系统作为起始治疗(Ⅲ,B)。
卵圆孔未闭
流行病学显示,约30%患者为隐匿性缺血性卒中,研究发现,卵圆孔闭合术可用于隐匿性卒中。指南建议,隐匿性缺血性卒中或TIA、伴卵圆孔未闭且无深静脉血栓患者,不推荐用卵圆孔闭合术(Ⅲ,A),原指南证据级别为Ⅱb。



 京公网安备 11010502033353号
京公网安备 11010502033353号